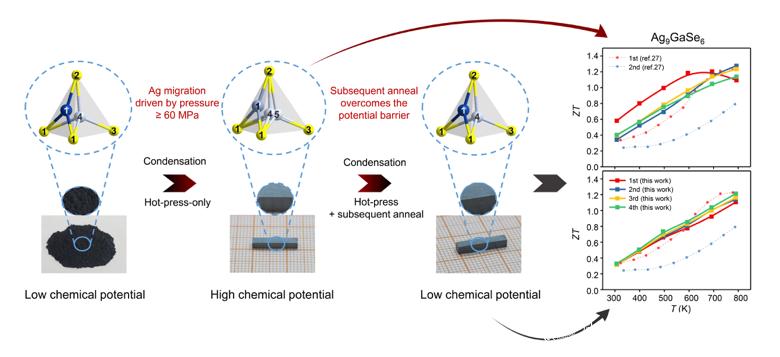
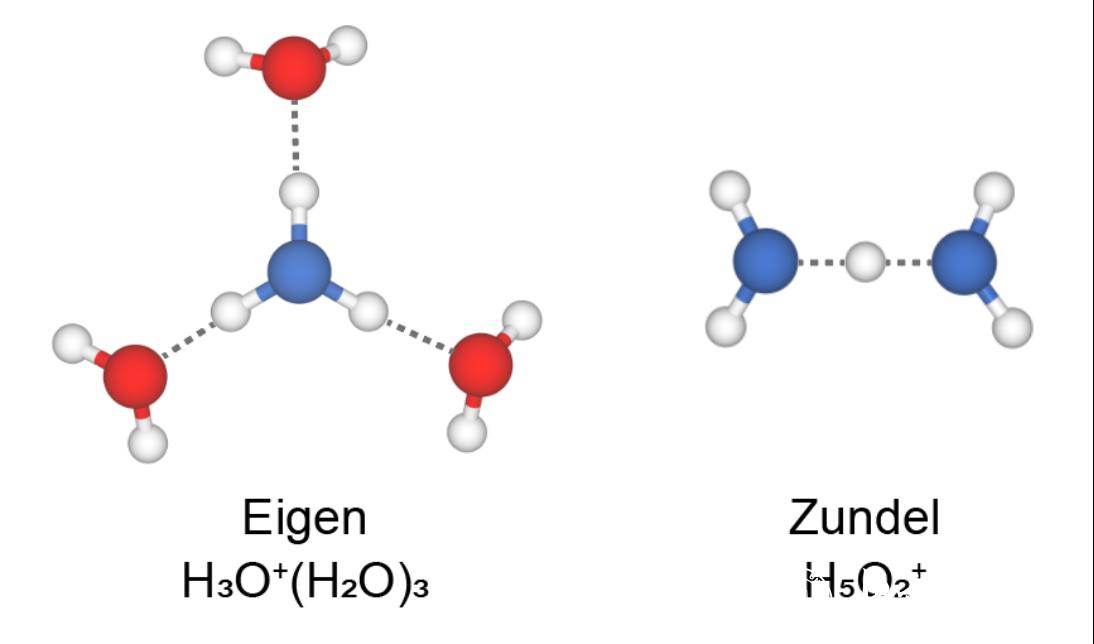
初三化学溶液知识点
发表日期:2024-01-31 | 作者: | 电话:166-1980-1137 | 累计浏览:
初三化学溶液知识点
什么是溶液?
溶液是由溶质和溶剂组成的混合物。其中,溶质是能够在溶剂中溶解的物质,而溶剂是用来溶解溶质的物质。
溶解度和饱和度
溶解度是指在特定温度下,单位溶剂中能够溶解的最大溶质量。溶解度与溶质和溶剂的性质、温度有关。
饱和溶液是指在一定温度下溶剂已经溶解了最大可能的溶质量。当溶质进一步加入时,无法继续溶解,会出现沉淀或溶质无法完全溶解的情况。
浓溶液和稀溶液
浓溶液是指单位溶剂中含有较多的溶质。稀溶液则相反,指单位溶剂中含有较少的溶质。
溶解过程中的热效应
在溶解过程中,溶质和溶剂之间会发生相互作用,从而产生热效应。根据热效应的不同,溶解过程可以分为吸热反应和放热反应。
溶解过程中吸收热量的称为吸热反应,反之则为放热反应。
溶解度曲线
溶解度曲线是指在一定温度下,溶质在溶剂中的溶解度随溶质的质量变化的曲线。根据溶质的溶解度变化,溶解度曲线可分为以下几种类型:
- 正常溶解度曲线:溶解度随溶质质量的增加而增加。
- 不完全溶解曲线:溶解度随溶质质量的增加先增加后减少。
- 饱和溶解度曲线:溶解度在一定质量范围内保持不变。
浓度的计算
浓度是描述溶液中溶质含量的指标,常用的浓度单位有质量浓度、体积浓度、摩尔浓度等。
质量浓度是指溶质的质量与溶液的体积之比,常用单位为克/升。
体积浓度是指溶质的体积与溶液的体积之比,常用单位为毫升/升。
摩尔浓度是指溶质的摩尔数与溶液的体积之比,常用单位为摩尔/升。
常见的溶液
常见的溶液有盐水、糖水、醋、碳酸氢钠溶液等。这些溶液在日常生活中使用广泛。
总结
了解溶液的基本概念和性质对于化学学习非常重要。掌握溶解度和浓度的计算方法以及溶解过程中的热效应对于实验操作和理论研究都有着重要意义。